Qual é o valor do volume molar na CNTP?
Qual é o valor do volume molar na CNTP?
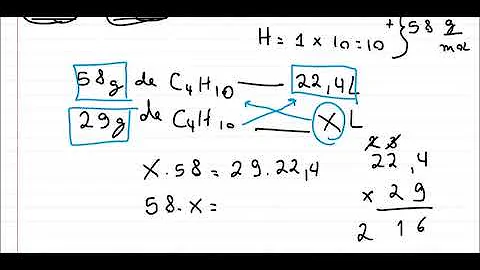
22,4 L Assim, quando consideramos as Condições Normais de Temperatura e Pressão (CNTP), em que a pressão é igual a 1 atm e a temperatura é de 273 K (0ºC), temos que o volume ocupado por 1 mol de qualquer gás sempre será de 22,4 L. Esse valor corresponde ao volume molar dos gases.
Como calcular o volume de um gás fora da CNTP?
Exemplo 6: Gás fora das CNTP
- Volume molar nas CNTP. 1 mol = 22,4 litros.
- P . V = n . ...
- PV = nRT.
- PV = (m/MM) RT.
- Exemplo:
- Resolução:
Qual o valor da CPTP?
273,15 K Sendo assim, as Condições Padrão de Temperatura e Pressão (CPTP) admitem os valores de 273,15 K para a temperatura padrão e 100 000 Pa (1 bar) para a pressão padrão; já para as Condições Normais de Temperatura e Pressão (CNTP), cabem os valores de temperatura igual a 273,15 K e pressão de 101 325 Pa (1 atm).
Como calcula CNTP?
R=PxVT. R = P x V T . Assim, podemos calcular o valor da constante dos gases (R) usando a equação acima e considerando as CNTP: R=1atmx22,4L/mol237K.
Qual é o volume de um gás?
V é o volume que um gás ocupa e corresponde ao volume do recipiente no qual se encontra. As unidades de volume estão relacionadas a seguir: 1 L = 10 - cm³ = mL
Qual a pressão normal dos gases?
A pressãonormal equivale a 1 atm, que é igual a 760 mmHg, que é aproximadamente igual a 100 kPa. A temperaturanormal equivale a 0°C, que é igual a 273 K. Aplicando esses valores de CNTP na equação de estado dos gases, pode-se calcular o volume molar e a constante dos gases (R).
Qual o volume molar de um gás?
Sabendo-se que o volume molar de um gás nas condições normais de temperatura e pressão (CNTP) é igual a 22,4 L e que R = 0,082 atm ∙ L ∙ K –1 ∙ mol –1, o maior número de moléculas está contido em 1,0 L de:
Como calcular o volume de uma amostra de gás hidrogênio?
1 (PUC Minas) Sob condições apropriadas, gás acetileno (C 2 H 2 (g)) e ácido clorídrico reagem para formar cloreto de... 2 Calcule o volume de uma amostra de 3,4 mol de gás hidrogênio (H 2) na CNTP. More ...














