Qual o valor da energia de ativação da reação?
Índice
- Qual o valor da energia de ativação da reação?
- O que é barreira energética?
- Qual a unidade de energia de ativação?
- O que é energia de ativação de uma enzima?
- Qual o valor da energia de ativação da reação catalisada?
- O que é o chamado estado de transição em uma reação química?
- Qual a energia necessária para formar o complexo ativado?
- Qual a energia de ativação para uma reação?
- Qual é a energia de ativação?
- Como reduzir a energia de ativação?
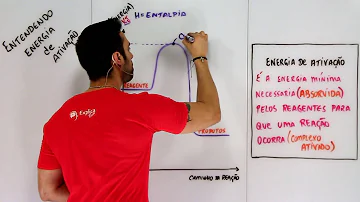
Qual o valor da energia de ativação da reação?
Além disso, a energia de ativação é dada pela diferença entre a energia necessária para a reação iniciar e formar o complexo ativado (topo mais alto) e a energia que os reagentes já possuíam no início da reação.
O que é barreira energética?
A barreira energética corresponde à existência do chamado estado de transição. Esta descrição pode ser feita graficamente: Variação da energia livre da reação. A linha a vermelho (cheio) representa a reação na ausência de catalisador; a azul (tracejado), na presença de enzima.
Qual a unidade de energia de ativação?
Tipicamente a energia de ativação é considerada como sendo a energia em quilojoule necessária para que 1 mol de reagente reaja.
O que é energia de ativação de uma enzima?
Essa energia de partida, que dá um “empurrão” para que uma reação química aconteça, é chamada de energia de ativação e possui um determinado valor. A enzima provoca uma diminuição da energia de ativação necessária para que uma reação química aconteça e isso facilita a ocorrência da reação.
Qual o valor da energia de ativação da reação catalisada?
O valor da energia de ativação varia de uma reação química para outra. Assim, quanto maior for a energia de ativação, maior será o tempo para que a reação ocorra. No caso da reação de decomposição do peróxido de hidrogênio, a sua energia de ativação é muito elevada: 76 kJ/mol, por isso a reação se dá de forma lenta.
O que é o chamado estado de transição em uma reação química?
O estado de transição numa reação química é uma configuração particular ao longo da coordenada de reação que se define como o estado que corresponde ao máximo de energia ao longo dessa coordenada.
Qual a energia necessária para formar o complexo ativado?
A energia mínima necessária para formar o complexo ativado é chamada de energia de ativação e a reação só ocorre se houver a formação do complexo ativado.
Qual a energia de ativação para uma reação?
Energia de ativação é a energia mínima para que uma reação química possa ocorrer, ou seja, é um dos fatores determinantes para a ocorrência de uma reação, juntamente com o contato e a colisão favorável entre as moléculas dos reagentes. Modelo de colisão favorável entre os reagentes de uma reação
Qual é a energia de ativação?
A energia de ativação é a menor quantidade de energia necessária que deve ser fornecida aos reagentes para a formação do complexo ativado e para a ocorrência da reação. Ouvir: Energia de ativação.
Como reduzir a energia de ativação?
Para reduzir a energia de ativação e, assim, acelerar a reação, uma alternativa é utilizar um catalisador, o qual é uma substância química que deve ser adicionada ao meio reacional ...














